Sinalização em procariotos
O endereçamento de proteínas não é um evento
recente na evolução, mesmo as bactérias mais primitivas
utilizam-se de marcações para enviar proteínas sintetizadas
no citossol para a membrana celular, para a membrana externa, para o espaço
periplasmático ou até mesmo para o meio extracelular.
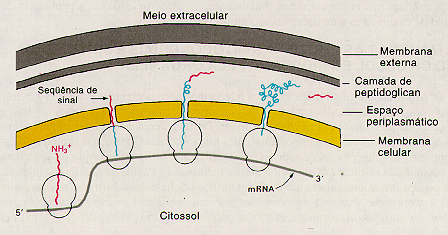
O ponto mais claro até o momento é a marcação de proteínas direcinadas para o espaço periplasmático e para a membrana externa. Aqui é utilizada uma sequência guia presente na ponta amino-terminal muito similar ao peptídeo sinal de proteínas secretadas em eucariotos. Estas sequências guia possuem entre 16 e 26 aminoácidos, possuem uma região N-terminal de carga positiva, uma região central de carga hidrofóbica, e um segmento de quebra de hélice.
Abaixo vemos a sequência guia da pró-lipoproteína,
o percursor da proteína mais abundante na embrana externa de E.
coli. Como nos eucariotos aqui também a sequencia guia é
clivada por uma peptidase sinal no ponto de rompimento da hélice.
+H3N - MKATKLVLGAVILGSTLLAG | CSSN
| - Ponto de clivagem da peptidase sinal
A tradução e a translocação da cadeia
polipeptídica são ventos quase que sobrepostos mas, não
são mecanicamente aclopados. Em E. coli, por exemplo, a translocação
de um polipeptídeo através da membrana é catalizada
por acompanhantes e por um complexo proteico presente na membrana (translocase).
SecB, um acompanhante da exportação, mantém as cadeias
nascentes em um estado não enovelado ou parcialmente enovelado,
possibilitando assim, que elas atravessem a membrana. SecB também
apresenta o polipeptídeo a SecA, um constituinte da translocase,
que em conjunto com SecY e SecE promovem a translocação.
As forças responsáveis pela ativação da translocação
são ATP e força próton-motriz. SecA é
uma ATPase que possui uma alta afinidade pelo polipeptídeo no estado
com ATP perdendo-a no estado sem ATP. Hidrólises sucessivas de ATP
fazem com que a cadeia nascente seja passada de SecA para o canal SecY-SecE,
a força próton-motriz ativa então a passagem da proteína
através da membrana.
