Direcionamento de proteínas para lisossomos
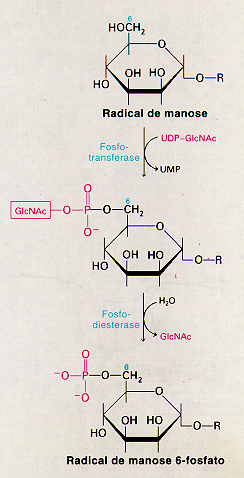
Todas as proteínas direcinadas para os lisossomos são
glicoproteínas; inicialmente elas adquirem, na fase Cis do Complexo
de Golgi, uma fosforila marcadora. Uma fosfotransferase adiciona então
uma fosfo-N-acetilglicosamina à 6-OH de uma manose. Finalmente uma
fosfodiesterase remove a ose adicionada, gerando uma manose-6-fosfato no
cerne oligosídico. A unidade manose-6-fosfato é reconhecida
por receptores presentes na membrana do Complexo de Golgi favorescendo
a ligação destas glicoproteínas aos receptores.
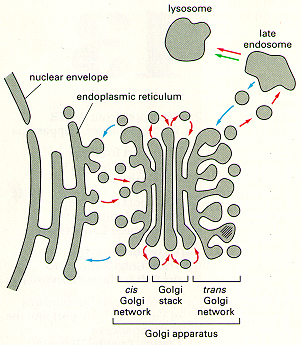
Vesículas contendo glicoproteínas ligadas à receptores
brotam da fase Trans do Complexo de Golgi e se ligam a vesículas
pré-lisossomicas, as quais são mais ácidas que as
provenientes do Complexo de Golgi. Esta diminuição do pH
promove a dissociação da glicoproteína de seu receptor,
estes pré-lisossomos se fundem a lisossomos maduros recebendo suas
enzimas. Neste ponto os receptores de manose-6-fosfato retornam ao Complexo
de Golgi através de grupo diferente de vesículas.
Este receptor, como o Transportador Vesicular de Acetilcolina e outros,
é reciclado podendo ser utilizado várias vezes. Caso não
ocorra a acidificação das vesículas não há
a dissociação do complexo enzima-receptor, consequentemente
o receptor de manose-6-fosfato não retorna ao Complexo de Golgi.
Na carência do receptor glicoproteínas que deveriam ter como
destino os lisossomos continuam na via de secreção e são
exportadas da célula.